A doença pulmonar obstrutiva crônica (DPOC) é uma das principais causas de hospitalização e mortalidade em todo o mundo.1 Uma das principais limitações no tratamento de pacientes com DPOC é a natureza heterogênea de sua patogênese.1 As evidências atuais sugerem que, em aproximadamente um terço dos pacientes com DPOC, a inflamação do tipo 2, com mediação eosinofílica, pode ser um fator patogênico importante, estando relacionada à progressão da doença e ao aumento da taxa de exacerbações, mesmo em uso de tríplice terapia como terapia padrão.1-6 Consequentemente, a inflamação do tipo 2 passou a ser um alvo terapêutico na DPOC.1
Nesta matéria, discutimos os resultados de ensaios terapêuticos recentes de medicamentos biológicos que têm como alvo essas vias e vislumbramos o futuro do desenvolvimento terapêutico de moduladores imunológicos de inflamação do tipo 2 na DPOC.
O artigo “Type 2 airway inflammation in COPD”, de Francesca Polverino e Don D. Sin, explora o papel da inflamação do tipo 2 na DPOC.1 Os autores destacam que a inflamação do tipo 2 na DPOC pode ser impulsionada por diferentes células e moléculas imunológicas, em comparação com a asma grave.1 Eles identificam os principais componentes envolvidos nessa inflamação, como eosinófilos e citocinas específicas, e discutem como esses elementos podem se tornar alvos terapêuticos.1
Esse artigo é significativo, pois amplia a visão fisiopatológica da DPOC, mostrando que há: a) sobreposição em subconjunto de pacientes e b) asma e DPOC comportam-se como duas doenças distintas e singulares em termos de patogênese.1 Isso tem implicações clínicas relevantes, pois pode levar ao desenvolvimento de tratamentos mais personalizados e eficazes (terapia-alvo) para pacientes com DPOC que apresentam inflamação do tipo 2.1
Polverino e Sin enfatizam a importância da inflamação do tipo 2 na DPOC em relação às exacerbações, que são episódios agudos de piora dos sintomas respiratórios.1 Essas exacerbações são eventos clínicos críticos na progressão da DPOC, pois estão associadas a um declínio acelerado da função pulmonar, pior qualidade de vida, aumento das hospitalizações e maior mortalidade.2 O artigo discute os mecanismos pelos quais a inflamação do tipo 2 pode levar a exacerbações da DPOC.1 Especificamente, os autores mencionam que as citocinas associadas à inflamação do tipo 2, como a interleucina-4 (IL-4), a interleucina-5 (IL-5) e a interleucina-13 (IL-13), podem potencializar a inflamação nas vias aéreas, aumentando a produção de muco e a hiperresponsividade brônquica.1 Esses fatores, por sua vez, podem predispor os pacientes a exacerbações cada vez mais frequentes e graves.1
Os ensaios clínicos recentes com terapias biológicas que visam a essas vias inflamatórias oferecem novas perspectivas de tratamento para um subgrupo de pacientes com DPOC que apresentam inflamação do tipo 2.1,3,4 Os autores sugerem que esses avanços podem mudar a abordagem terapêutica para a DPOC, tornando-a mais personalizada e promissora.1
Em resumo, o artigo ressalta a importância da inflamação do tipo 2 na DPOC, com destaque especial para o seu papel nas exacerbações.1 Os autores argumentam que a identificação de pacientes com DPOC que apresentam inflamação do tipo 2 é crucial, pois esses pacientes podem se beneficiar de terapias específicas que visam reduzir a inflamação e, consequentemente, as exacerbações.1 Essa abordagem mais particularizada pode melhorar e até mesmo ampliar os resultados dos desfechos clínicos para esses pacientes.1
Nesse contexto, o dupilumabe, medicamento biológico anti-IL-13/IL-4, passa a ter um protagonismo singular, baseado em robustas evidências no tratamento-alvo da DPOC, objetivando à redução da taxa de exacerbações, à regressão mesmo que parcial do remodelamento das vias aéreas, a obtenção de ganhos em função pulmonar e, como consequência indireta, à redução da morbidade e da mortalidade relacionadas à DPOC.3,4
Na sequência, discutiremos e comentaremos dois artigos pivotais que substanciam a indicação de dupilumabe para pacientes portadores de DPOC com perfil inflamatório tipo 2.

Estudo BOREAS
O artigo “Dupilumab for COPD with Type 2 Inflammation Indicated by Eosinophil Counts”, de S. P. Bhatt, K. F. Rabe, N. Hanania, D. Singh e colaboradores, aborda um tópico relevante no manejo da DPOC, especificamente a aplicação de dupilumabe, um anticorpo monoclonal, para pacientes com inflamação do tipo 2 identificada por contagens elevadas de eosinófilos.3
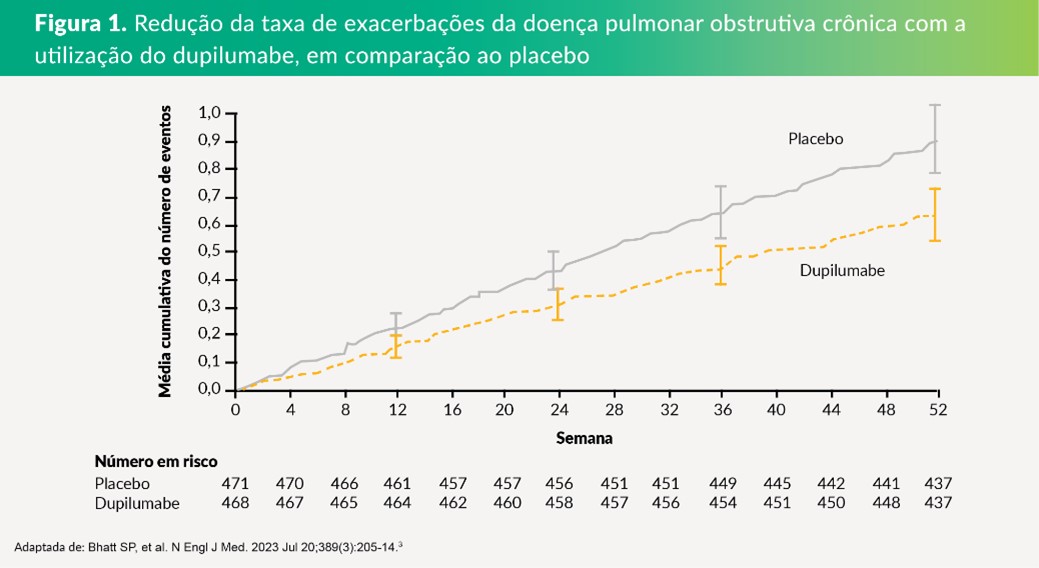
Trata-se de ensaio clínico multicêntrico de fase 3, duplo-cego e randomizado.3 Foram estudados pacientes com DPOC que apresentavam contagem de eosinófilos no sangue de pelo menos 300 células por microlitro e risco elevado de exacerbações, apesar do uso da terapia tripla com antimuscarínico de ação prolongada (LAMA), beta-agonista de ação prolongada (LABA) e corticosteroide inalatório (CIS).3
Os pacientes foram randomizados para receber dupilumabe (300 mg) ou placebo por via subcutânea a cada duas semanas.3 O desfecho primário foi a taxa anualizada de exacerbações moderadas ou graves.3 Os desfechos secundários foram a mudança no volume expiratório forçado no primeiro segundo (VEF1) pré-broncodilatador e nas pontuações do Questionário Respiratório de St. George (SGRQ; faixa de 0 a 100, com pontuações mais baixas indicando melhor qualidade de vida) e da Avaliação de Sintomas Respiratórios na Doença Pulmonar Obstrutiva Crônica (E-RS-DPOC; faixa de 0 a 40, com pontuações mais baixas indicando sintomas menos graves).3
Resultados
- Um total de 939 pacientes randomizados: 468 para o grupo de dupilumabe e 471 para o grupo de placebo.3
- A taxa anualizada de exacerbações moderadas ou graves foi de 0,78 (intervalo de confiança [IC] de 95%: 0,64 a 0,93) com dupilumabe e de 1,10 (IC de 95%: 0,93 a 1,30) com placebo (razão de taxa: 0,70; IC de 95%: 0,58 a 0,86; p<0,001).3 (Figura 1)
- O VEF1 pré-broncodilatador aumentou em relação ao valor inicial até a semana 12 em uma média dos quadrados mínimos (LS), de 160 mL (IC de 95%, 126 a 195) com dupilumabe e 77 mL (IC de 95%: 42 a 112) com placebo (diferença média dos LS: 83 mL; IC de 95%: 42 a 125; p<0,001), uma diferença que foi mantida até a semana 52.3
- Na semana 52, a pontuação no SGRQ melhorou em uma média dos LS de −9,7 (IC de 95%: −11,3 a −8,1) com dupilumabe e −6,4 (IC de 95%: −8,0 a −4,8) com placebo (diferença média dos LS: −3,4; IC de 95%: −5,5 a −1,3; p=0,002).3
- A pontuação no E-RS-DPOC na semana 52 melhorou em uma média dos LS de −2,7 (IC de 95%: −3,2 a −2,2) com dupilumabe e −1,6 (IC de 95%: −2,1 a −1,1) com placebo (diferença média dos LS: −1,1; IC de 95%: −1,8 a −0,4; p=0,001).3
- O número de pacientes com eventos adversos que levaram à descontinuação de dupilumabe ou placebo, eventos adversos graves e eventos adversos que levaram a óbito foi equilibrado entre os dois grupos.3
Estudo NOTUS
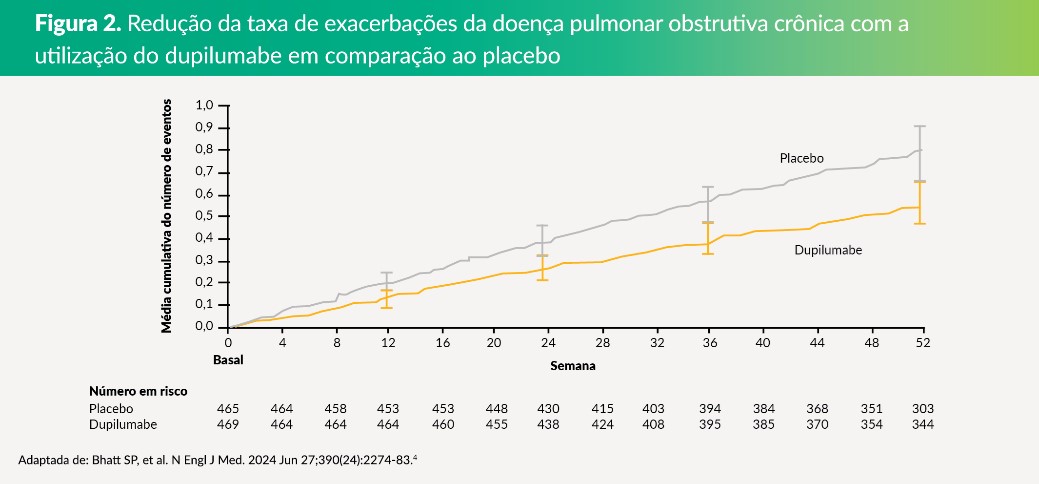
Trata-se do segundo estudo clínico multicêntrico de fase 3, duplo-cego e randomizado, no qual foram estudados pacientes com DPOC que apresentavam contagem de eosinófilos no sangue de 300 células por microlitro ou mais para receber dupilumabe (300 mg) ou placebo por via subcutânea a cada duas semanas.4 O desfecho primário foi a taxa anualizada de exacerbações moderadas ou graves.4 Os desfechos secundários incluíram as mudanças em relação ao valor basal no VEF1 pré-broncodilatador nas semanas 12 e 52 e na pontuação total do SGRQ na semana 52.4
Resultados
- Um total de 935 pacientes randomizados: 470 foram designados para o grupo de dupilumabe e 465 para o grupo de placebo.4
- A taxa anualizada de exacerbações moderadas ou graves foi de 0,86 (IC de 95%: 0,70 a 1,06) com dupilumabe e 1,30 (IC de 95%: 1,05 a 1,60) com placebo; a razão da taxa, em comparação com o placebo, foi de 0,66 (IC de 95%: 0,54 a 0,82; p<0,001).4 (Figura 2)
- O VEF1 pré-broncodilatador aumentou em relação ao valor basal até a semana 12 com dupilumabe (mudança média dos LS: 139 mL [IC de 95%: 105 a 173]), em comparação com o placebo (mudança média dos LS: 57 mL [IC de 95%: 23 a 91]), com uma diferença média dos LS significativa na semana 12, de 82 mL (p<0,001), e na semana 52, de 62 mL (p=0,02).4
- Nenhuma diferença significativa entre os grupos foi observada na mudança nas pontuações do SGRQ em relação ao valor basal até 52 semanas.4
- A incidência de eventos adversos foi semelhante entre os dois grupos e consistente com o perfil estabelecido de dupilumabe em suas indicações aprovadas.4
Comentários
Foco em biomarcadores: Os estudos BOREAS3 e NOTUS4 destacam-se por direcionar a pesquisa para um subgrupo específico de pacientes com DPOC, ou seja, aqueles com inflamação do tipo 2.
O uso de contagens de eosinófilos como biomarcador não invasivo para identificar o perfil desses pacientes é um avanço extremamente significativo, permitindo uma abordagem assertiva, mais personalizada e potencialmente mais eficaz, refletindo o atingimento dos seus desfechos primários e secundários em ambos os estudos, ressaltando que, no NOTUS, o dupilumabe reduziu as exacerbações em uma magnitude nunca antes vista com um biológico experimental em um estudo clínico de DPOC de fase 3.1,3,4
Inovação terapêutica: O dupilumabe, que já demonstrou sucesso no tratamento da asma7 e outras condições inflamatórias do tipo 2,8 representa uma opção inovadora no tratamento da DPOC.3,4 Explorar sua eficácia em um novo contexto pode abrir portas para novas estratégias terapêuticas e melhorar o controle da doença em subpopulações específicas.
Metodologia e dados: Os estudos utilizam método rigoroso e fornecem dados robustos sobre a eficácia e a segurança do dupilumabe em pacientes com inflamação do tipo 2.3,4
Isso pode contribuir significativamente para a base de evidências existentes e orientar futuras práticas clínicas.
População dos estudos: Em ambos os estudos, foram excluídos pacientes com histórico ou diagnóstico de asma de acordo com as diretrizes do Global Initiative for Asthma (GINA) de 2018. Isso foi feito para garantir que a eficácia fosse especificamente relacionada à DPOC, e não combinada a potenciais resultados relacionados à asma. Esse procedimento garantiu dados robustos em uma coorte sem asma, demonstrando o efeito de dupilumabe na DPOC.3,4
Ensaio clínico randomizado (ECR) e controlado: Se o estudo é um ECR, isso geralmente fornece uma evidência mais forte do que estudos observacionais, pois a randomização reduz o viés e a confusão.9
Benefícios adicionais: Os estudos apresentam evidências de que o dupilumabe pode oferecer benefícios significativos para pacientes com DPOC que têm inflamação do tipo 2 e estão sem resposta plena à terapia convencional (LAMA/LABA/ICS).3,4 Isso pode incluir melhora na função pulmonar, redução de exacerbações e melhor controle dos sintomas.3,4
Segurança: Os estudos mostram que o dupilumabe tem um perfil de segurança aceitável e efeitos adversos limitados, contribuindo para a força da evidência a favor do tratamento.3,4
Conclusões
Os estudos analisados fornecem evidências promissoras sobre o papel potencial de dupilumabe no tratamento da DPOC com características inflamatórias do tipo 2.3,4 Isso pode representar um avanço significativo na personalização do tratamento para essa condição crônica complexa.1
A coerência, a consistência e a uniformidade dos resultados mostrados nos estudos BOREAS e NOTUS, diante de uma doença de heterogeneidade complexa, estabelecem a força da evidência para a indicação do dupilumabe como tratamento adicional para pacientes portadores de DPOC com perfil exacerbador, com nítida presença de inflamação do tipo 2 e que não estão respondendo à terapia convencional para esse fenótipo.3,4
Como você avalia este conteúdo?
Sua opinião ajudará outros médicos a encontrar conteúdos mais relevantes.




